Выполнение имплантации, самого успешного и эффективного метода возвращения натуральной улыбки, постоянно совершенствуется, как и стоматологическое лечение в целом. Пациентам предлагаются инновационные методики, которые дают лучший эффект или сокращают длительность и стоимость лечения. Одним из серьезных достижений последних лет стала барьерная мембрана, которая устанавливается в условиях дефицита костной ткани.
Атрофия альвеолярного отростка практически неизбежна у людей, которые нуждаются в имплантации. Некоторые длительно затягивают с терапией, из-за чего кость успевает рассасываться, а другие имеют врожденные особенности строения челюстного аппарата. В любом случае, выполнение дентальной имплантации при атрофических явлениях в костной ткани становится невозможным. Подобная ошибка грозит следующими неблагоприятными последствиями:
- Расшатывание, западение или даже выпадение имплантата (иногда его выпадение происходит достаточно травматично, с захватыванием костной ткани пациента);
- Невозможность выполнения костной пластики в будущем из-за чрезмерного истончения кости (любое вмешательство грозит переломами).
Более того, рассасывание костей челюсти настолько серьезно вредит пациенту, что даже без имплантации костная пластика остается необходимым хирургическим вмешательством.
Постепенно прогрессирующая атрофия приводит к тому, что лицо становится ассиметричным и некрасивым: усугубляются морщины, нарушается функционирование мимических мышц и так далее. Значительно страдает жевательная функция челюстей, из-за чего пациенты плохо едят и начинаются проблемы с желудочно-кишечным трактом. В запущенных ситуациях ощутимо нарушаются речь и глотание, реже страдают дыхательные движения. Поэтому костная пластика с дополнительной установкой барьерной мембраны обязательно должна выполняться сразу же после обнаружения проблемы.
Костная пластика — решение проблемы атрофии
Уже достаточно давно костная пластика признана наиболее эффективным методом восстановления ширины и высоты альвеолярного отростка. Постоянно методика модифицируется и становится более безопасной и менее травматичной. Кроме того, стоматологи стараются достигнуть условий, при которых будет возможно выполнение одновременной имплантации.
Существует несколько основных методик костной пластики:
- Синус лифтинг. Восстановление объема кости на верхней челюсти в области проекции дна гайморовой пазухи. Операция выполняется чаще остальных, так как именно здесь преимущественно отмечается рассасывание кости. Суть хирургического вмешательства заключается в том, что стоматолог одним из способов (закрытым или открытым) получает доступ к слизистой оболочке верхнечелюстного синуса. Он отсоединяет часть мембраны от надкостницы, а образовавшуюся полость заполняет подготовленным материалом натурального или синтетического происхождения.
- Расщепление альвеолярного гребня. Эффективная методика коррекции ширины любой из челюстей. Сначала альвеолярный отросток разрезается и раздвигается, после чего внутрь помещается трансплантат. Достоинство методики — погружение конструкции в губчатую ткань челюсти, где активно идет регенерация и подпитка костного блока. Именно поэтому здесь не требуется применение дорогостоящих костнопластических материалов.
- Направленная тканевая регенерация. Такая костная пластика включает в себя два компонента: трансплантат и коллагеновую мембрану. Эти две составляющих, взаимодействуя между собой, помогают восстановить дефицит как ширины, так и высоты альвеолярного отростка на любом участке челюстей. Методика редко используется с одновременной имплантацией.
- Подсадка костного блока. Данная методика подразумевает использование натурального, лучше аутогенного трансплантата, который подсаживается на участок, где планируется имплантация и атрофировалась костная ткань. Недостаток методики — подсоединение трансплантата у той области кости, где нет кровеносных сосудов. Приживление в таких условиях происходит медленно.
Пациенты склонны к страху перед костной пластикой, так как она является полноценным оперативным вмешательством на зубах. Однако все манипуляции проводятся в условиях местного или общего обезболивания, так что не приносят никакого дискомфорта. Риск осложнений при данной манипуляции минимален, а польза неоспорима. Даже если атрофии альвеолярного отростка не позволяет сразу провести имплантацию, а пациентам приходится ждать полгода, пока приживутся имплантаты, все равно лучше отдать предпочтение костной пластике, а не альтернативным методикам восстановления зубов. Тем более в современных условиях есть множество конструкций, повышающих пользу и результативность костной пластики, например, фиксация барьерной мембраны.
Коллагеновая мембрана Genoss
Многослойная резорбируемая коллагеновая мембрана Genoss изготовлена из бычьего коллагена I типа.
Collagen Membrane, Genoss идеально стабилизирует костный материал, прекрасно эпителизируется в открытом состоянии, поэтому широко применяется при всех возможных операциях направленной костной регенерации.
Collagen Membrane GCM1520
Collagen Membrane GCM3040
Collagen Membrane GCM2030
Collagen Membrane GCM1020
Что такое барьерные мембраны?
Барьерная мембрана — одно из самых современных и успешных изобретений в стоматологической практике. Такие конструкции активно используются практически во всех оперативных вмешательствах. Барьерные мембраны для костной пластики при имплантации позволяют предотвратить атрофические явления в альвеолярном отростке и способствуют одномоментной успешной фиксации искусственных корней. Мембрана влияет на регенераторные способности кости, увеличивая их, не пропускает внутрь опасные для костных клеток остеокласты и минимизирует риск проникновения патогенных агентов. Благодаря барьерной мембране приживление трансплантата ускоряется, как и общее лечение пациента.
Мембрана для костной пластики представляет собой очень тонкую и достаточно эластичную пластинку, которая крепится к кости титановыми штифтами. Таким образом происходит отделение десны от костного материала в процессе формирования натуральной ткани челюсти.
Виды мембран
Существует два типа барьерных мембран, которые широко используются в стоматологии:
- Резорбируемые. Такая конструкция постепенно рассасывается. Она не требует отдельного удаления, то есть дополнительного оперативного вмешательства, а значит приносит меньший травматизм.
- Нерезорбируемые. Мембраны такого типа самостоятельно не рассасываются, из-за чего пациенты нуждаются в дополнительном этапе лечения — удалении конструкции. В большинстве случаев они изготавливаются из титана. Крепятся такие мембраны при наличии серьезного дефицита костной ткани, восполненного гранулами остеогенного материала. После того, как альвеолярный отросток и мягкие ткани десны восстановятся, барьерная мембрана удаляется.
Стоматолог самостоятельно подбирает оптимальную мембрану для конкретного клинического случая. Он должен учитывать, что резорбируемые конструкции недостаточно хорошо фиксируют трансплантаты, поэтому их используют лишь при незначительных атрофиях.
Характеристики и преимущества
Материалом для изготовления Bio Gide служит натуральный свиной коллаген, для получения которого организовано комплексное контролируемое производство. Наличие сертификатов качества подтверждает, что состав не проходит дополнительную обработку химикатами, и подвергается специальной очистке, нивелирующей влияние антигенных факторов.
Мембранная структура не предусматривает наличия химических или шовных элементов – двухслойный материал объединяет уплотненный и пористый элементы, способствующие ускоренной интеграции, и предотвращающие разрастание фиброзных тканей на поврежденном участке. Надежность контакта с поверхностью костной структуры, а также сохранение функциональных характеристик под действием влаги, обеспечиваются особым волокнистым строением материала.
Популярность мембранной регенерации в стоматологии определяется рядом положительных аспектов, характерных для использования данной технологии:
- Используемые материалы имеют натуральное происхождение;
- Мембрана стимулирует восстановление костной ткани;
- Качественная адгезия позволяет обойтись без вспомогательной фиксации;
- Эластичность структуры гарантирует стабильное положение;
- Материал проводит все питательные вещества, необходимые для регенерации;
- Изделие защищает имплантат от смещения и прорастания тканей.
Кроме того, важным положительным фактором является самостоятельная резорбция мембраны, исключающая необходимость в повторном хирургическом вмешательстве.
Зачем и когда устанавливать мембрану?
Барьерная мембрана выполняет сразу несколько функций, способствующих выздоровлению пациента. Конструкция надежно фиксирует остеогенный материал в том месте и положении, куда его установил стоматолог. Также мембрана не пропускает разрушающие кость клетки — остеокласты, которые в норме отвечают за баланс обменных процессов в альвеолярном отростке. Дополнительной функцией мембраны является защита от инфекции. В случае проведения синус лифтинга мембрана устанавливается под дно гайморовой пазухи и снижает риск проникновения костнопластического материала в синус через перфоративные отверстия в слизистой оболочке.
Показания для использования барьерной мембраны:
- Предотвращение рассасывания костной ткани в альвеолярном гребне после удаления зуба (если лечение не выполняется сразу и пациенту придется некоторое время убрать нагрузку с данного участка);
- Любой из видов костной пластики (удерживание костнопластического материала);
- Имплантация зубов с одномоментной костной пластикой (армирующая функция);
- Выполнение лоскутных оперативных вмешательств при пародонтите.
Барьерные мембраны появились не так давно, а потому их стоимость остается высокой. Стоматологи принимают решение в зависимости от финансового состояния пациента и иногда могут отказываться от их применения. В целом, использование барьерной мембраны позволяет лучше контролировать результат костной пластики и уменьшить вероятность развития неблагоприятных исходов лечения.
Виды стоматологических мембран
Виды стоматологических мембран делятся на две группы — резорбируемые и нерезорбируемые.
Нерезорбируемые мембраны по окончании лечения необходимо удалять, так как они не рассасываются. А повторное оперативное вмешательство, что очевидно, — это всегда повторная травматичность и, как следствие, увеличенный срок восстановления тканей до полного заживления, риск возможных осложнений и воспалительных реакций, увеличенные время и цена стоматологического лечения.
Резорбируемые мембраны удалять не надо. Они полностью рассасываются. Соответственно, в разы уменьшается риск травматичности тканей, время лечения, ускоряется процесс регенерации, а значит, общий срок восстановления пациента и цена стоматологического лечения.
Как устанавливать барьерную мембрану?
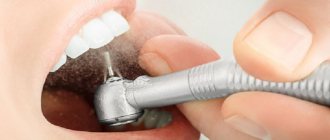
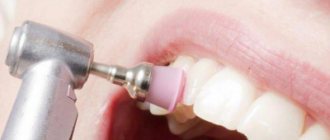
Инновационная методика использования барьерной мембраны требует определенного опыта от стоматолога, а также четких знаний о технике выполнения этапа. Фиксация конструкции проводится следующим образом:
- Выполнение местной или общей анестезии с добавлением седативных препаратов (последний пункт необходим не всегда);
- Разрез наружных мягких тканей десны и отодвигание их от кости альвеолярного отростка;
- Восполнение нужного количества костной ткани одним из выбранных заранее способов;
- Фиксирование современной конструкции из коллагена или металла специальными винтиками из титана к соседним зубам или к самой кости челюсти;
- Обратное укладывание мягких десенных тканей и закрепление их с помощью хирургических швов.
При использовании мембраны, которая не рассасывается, через определенное время практически все этапы повторяются для снятия конструкции.
Обязательным условием для успешного выздоровления пациента является тщательный уход за ротовой полостью в послеоперационном периоде. Человек должен соблюдать личную гигиену во рту и следовать всем рекомендациям стоматолога. Важен также отказ от курения за несколько дней до операции и на весь период реабилитации.
Успех реабилитации пациентов после дентальной имплантации определяется достаточным количеством костной ткани в участке имплантации.
Заполнение дефектов кости заменителями кости является процедурой выбора для поддержания кости, но врастание соединительной ткани из слизистой оболочки может нарушить процесс сращивания заменителя кости со стенками дефектов.
Использование мембраны для стоматологии в качестве барьера указывается в научной литературе как наиболее приемлемое решение данной проблемы.
Направленная регенерация кости (НРК) — это метод, который основан на концепции отделения кости от мягких тканей, то есть предотвращение апикальной миграции эпителия десны и соединительной ткани внутри дефекта с мембраной в роли барьера. Использование мембраны способствует пролиферации клеток, способных к регенерации, и их дифференцировке в желаемый тип тканей.
Для направленной регенерации кости необходимо пять условий:
- Использование соответствующей мембраны;
- Достижение первичного заживления мягких тканей;
- Создание и поддержание участка, защищенного мембраной;
- Адаптация и стабилизация мембраны с окружающей костью;
- Достаточно длительный период заживления.
Согласно Hardwick и соавт., основная цель мембраны заключается в создании подходящих условий, при которых максимально реализуется естественный биологический потенциал функциональной регенерации.
Свойства и виды мембран для стоматологии
Создание и предварительная подготовка участка, где находится сгусток крови, предотвращение воспаления, которое может возникнуть в результате проникновения бактерий, изоляция пространства для регенерации от нежелательных тканей и обеспечение механической стабильности и компактности организованного коагулята — это лишь немногие из факторов успешной костной регенерации.
Следует упомянуть их роль в предотвращении проникновения эпителиальных клеток в костный материал, а также в усилении фиксации применяемого костного заменителя.
Обязательные свойства мембраны для стоматологии:
- Полная биологическая совместимость;
- Барьерная активность (профилактика пролиферации мягких тканей);
- Обеспечение соответствующей интеграции окружающих тканей;
- Способность сохранить участок для роста новой альвеолярной кости;
- Иммунологическая инертность;
- Простота применения.
Мембрана должна противостоять жевательной силе и сокращать натяжение тканей.
При этом критически важна способность мембраны интегрироваться с сохранением окружающих тканей и эффективно подавлять миграцию эпителия.
На основании клинических и гистологических исследований различных барьерных материалов, ни один из них не показал себя идеальным для каждой клинической ситуации. Каждый материал имеет определенные характеристики, преимущества и ограничения.
В зависимости от реакции на их биологическое окружение, мембраны могут быть сгруппированы как нерезорбируемые и резорбируемые.
Нерезорбируемые мембраны для стоматологии
сохраняют структуру и форму в тканях, и для их удаления необходимо провести еще одну операцию; это увеличивает травматичность, удлиняет заживление раны, повышает стоимость и продолжительность всего лечения.
Резорбируемые мембраны
не нужно удалять после размещения, что существенно повышает практичность и оптимизирует стоимость лечения, а также риск хирургических осложнений.
Из-за природы резорбируемых мембран невозможно точно определить продолжительность их разрушения. Процесс деградации начинается сразу после размещения.
Данные из литературы относительно желательной продолжительности персистенции мембраны in vivo показывают, что она варьирует от 4 недель до нескольких месяцев.
Из-за биологической деградации резорбируемые мембраны вызывают реакцию тканей, которая может отрицательно влиять на заживление раны и нарушать регенерацию.
Идеальная биорезорбируемая мембрана для направленной регенерации кости обладает следующими характеристиками:
- Биосовместимость;
- Отсутствие воспалительной реакции;
- Полная резорбция, деградация и элиминация;
- Высокая технологичность материала;
- Оптимальное время резорбции.
Такая стоматологическая мембрана должна быть простой в обращении, в том числе в очерчивании формы дефекта, поддержании требуемой формы и конфигурации. Она должна просто и надежно фиксироваться, быть устойчивой к бактериальной адгезии и колонизации.
Важнейшим требованием к мембранам является время резорбции, которое должно соответствовать срокам образования новой костной ткани.
Для производства резорбируемых мембран используют два материала: синтетический алифатический полиэфир и коллаген из различных животных источников, в том числе из бычьего сухожилия, бычьей дермы, телячьей кожи или свиной дермы.
Коллагеновые мембраны для стоматологии
Коллаген является нерастворимым волокнистым белком, который выступает важным природным компонентом соединительной ткани.
Способность коллагена стимулировать адгезию, хемотаксис и физиологическую деградацию клеток-предшественников наряду с возможностью деградации делает его идеальным материалом для создания мембран для стоматологии.
Существует, по меньшей мере, 16 типов коллагена, обнаруженных в интерстициальных тканях, матриксе кости, хряще, эпителиальных, кровеносных сосудах, стекловидном теле глаза. Коллаген I, II и III типов составляет 80–90% коллагена организма.
Доступные на рынке коллагеновые продукты состоят в основном из коллагена I и III типа.
Коллаген отличается слабой иммуногенностью, активирует гемостаз и может увеличивать толщину ткани. Во время заживления раны происходит клинически значимое взаимодействие коллагена с различными типами клеток.
Коллаген производится из кожи животных или субпродуктов. Сначала материал выделяют и очищают ферментами и химическими веществами, затем обрабатывают различными путями.
Наиболее распространенная химическая модификация коллагена формирует поперечные соединения, как правило, при воздействии альдегида, который уменьшает поглощение воды, влияет на способность к расплавлению, скорость деградации и стабильность.
Этот модифицированный материал называется поперечно сшитым коллагеном.
Коллагеновые мембраны разлагаются макрофагами и полиморфно-ядерными нейтрофилами, и скорость поглощения различается в зависимости от источника и модификаций коллагена.
Резорбция коллагеновой мембраны начинается с воздействия фермента коллагеназы (матрикс-металлопротеиназа), которая делит молекулу коллагена в определенном положении. Образующиеся части денатурируются и превращаются в желатин, который затем разлагается на аминокислоты желатиназой и другой протеиназой.
Во время ферментативного расщепления он включается в лоскут для поддержки прикрепления новой соединительной ткани. Это может привести к увеличению толщины лоскута, который защищает и обеспечивает дальнейшее образование костной ткани.
Сшивание коллагена: за и против
Стабильность структуры, повышенная за счет сшивания, замедляет процесс деградации.
Суть этого процесса заключается в создании различных взаимных связей между конкретными аминокислотами, а также между аминокислотами и карбоксилатными группами, под воздействием химических и физических агентов.
Сшивание коллагена достигается ультрафиолетовым и гамма-излучением, гексаметиленглутаральдегидом, дифенилфосфорилазой и рибозой.
Такая обработка снижает in vivo скорость резорбции коллагенового материала и повышает механические характеристики. В западном научном мире до сих пор существуют споры по поводу того, применять мембраны для НРК из сшитого или несшитого коллагена.
Многие исследования доказали, что при перекрестном сшивании биодеградация мембраны коллагена удлиняется, и что это показывает положительное, хотя и ограниченное влияние на НРК в различных типах экспериментальных моделей дефектов. Другие исследования свидетельствуют, что их использование связано с начальной реакцией инородного тела, ухудшает интеграцию тканей и трансмембранную васкуляризацию.
Несмотря на все расхождения, было показано, что васкуляризация мембраны улучшается через 2 недели после ее подслизистой имплантации на крысиной модели. Вероятно, это связано с тем, что первоначальная гиперемия в соседней ткани направляет ангиогенез в направлении экспериментальной мембраны.
В 2006 году Schwarz и соавт. исследовали модель ангиогенеза в природных и поперечно сшитых коллагеновых мембранах, потому что предыдущие тесты показали, что васкуляризация в сшитых мембранах протекает слабее.
Исследователями был сделан вывод, что скорость ангиогенеза при использовании разных типов мембран не имеет статистически значимых отличий.
В исследованиях, проведенных сотрудниками Военно-медицинской академии Белграда, дефекты, покрытые сшитыми коллагеновыми мембранами, продемонстрировали лучший уровень васкуляризации по сравнению с несшитыми мембранами и пустыми дефектами.
В 2012 году Thoma и соавт. изучали различия в сшитом коллагене, применяя материал различной степени сшивания в мягких тканях мышей.
Проведенные гистопатологические и гистоморфометрические анализы через 3 и 6 месяцев после вмешательства показали, что степень сшивания материала обратно пропорциональна интеграции тканей, степени биодеградации коллагена и скорости образования сосудов.
Коллаген с наиболее низкой степенью сшивания демонстрирует лучшую интеграцию окружающей ткани, стабильность и ангиогенез.
Несмотря на несколько отрицательных характеристик, многие авторы предположили, что использование сшитых коллагеновых мембран имеет много преимуществ в направленной регенерации костной ткани.
Эффективность коллагеновых мембран
Некоторые пародонтальные микроорганизмы продуцируют коллагеназу — фермент, который может привести к преждевременной деградации мембраны. Это, в частности, Porphyromonas gingivalis и Bacteroides melaninogenicus.
Бактериальная колонизация может привести к ранней деградации коллагеновых мембран, поставив под угрозу процедуру. Как сшитые, так и несшитые мембраны для стоматологии подвергаются лизису в равной степени под воздействием бактериальных протеаз, хотя сшитые мембраны несколько более устойчивы к протеолизу.
Терапевтические концентрации антибактериальных агентов, в том числе хлоргексидина, миноциклина и доксициклина, частично подавляют ферментативную деградацию мембран.
Коллагеновые мембраны различаются по микроархитектуре (пространство между молекулами коллагена, волокнами, пучками и слоями) и поперечной сшиванию.
Микроархитектура и сшивание определяют характеристики мембраны, такие как сила натяжения, простота использования, гибкость, интеграция тканей и биодеградация.
Мембраны с более высокой степенью сшивания остаются целостными в течение более длительного периода времени. Исследования показали, что преждевременная резорбция мембраны или ее удаление могут привести к неполному заживлению кости, поэтому рекомендуется, чтобы стоматологические мембраны, применяемые в НРК, имели период деградации от 3 до 9 месяцев для полноценного формирования кости.
Биодеградация коллагеновых мембран
Rothamel и соавт. изучали биодеградацию с течением времени, реакцию ткани, тканевую интеграцию и васкуляризацию доступных на европейском рынке коллагеновых мембран, а также экспериментальных продуктов, используя крысиные модели.
Гистологические и гистометрические исследования проводились через 2, 4, 8, 16 и 24 недели после размещения мембраны. Был сделан вывод, что сшитые коллагены I и III типа коровьего и свиного происхождения удлиняют процесс биодеградации, но снижают тканевую интеграцию и васкуляризацию.
Кроме того, при использовании указанных продуктов в экспериментах возникает реакция инородного тела, которая характерна для сшитых мембран.
Это исследование подчеркиваетупомянутые различия между сшитыми и несшитыми мембранами, доказывая, что несшитые мембраны имеют лучшую васкуляризацию и тканевую интеграцию. Скорость поглощения прямо коррелирует со степенью сшивания — чем выше уровень связей, тем больше скорость резорбции.
В 2006 и 2008 годах Tal и соавт. клинически и гистологически изучали продолжительность барьерной функции мембран и биоинтеграцию в местах, которые были обработаны сшитыми и несшитыми коллагеновыми мембранами.
Особое внимание было уделено спонтанным перфорациям слизистой через барьерные мембраны. Было показано, что сшитые мембраны были более устойчивы к деградации тканей и что они сохраняли целостность в течение более длительного периода.
Недостатки коллагеновых мембран для стоматологии
По сравнению с нерезорбируемыми мембранами, коллагеновые мембраны не обладают способностью поддерживать объем. Применение костного трансплантата для сохранения пространства имеет тенденцию улучшать исход направленной регенерации кости.
Увеличение альвеолярного отростка можно ожидать в том случае, если пространство под коллагеновой мембраной создается и сохраняется строго в соответствующий период, пока формируется новая кость.
Поэтому целесообразно использовать материалы, которые обеспечат поддержку, чтобы предотвратить разрушение барьера из-за давления, создаваемого жевательной силой.
Сегодня мембраны для стоматологии обычно используются с различными костными трансплантатами и наполнителями. Когда биорезорбируемые мембраны идут в такой комбинации, результаты НРК оказываются намного более благоприятными, и сопоставимыми с нерезорбируемыми мембранами.
Это особенно справедливо при лечении локализованных горизонтальных дефектов.
При этом сами по себе остеопластические материалы менее эффективны, чем комбинация вспомогательного материала и барьера. Комбинация мембран с костным материалом помогает достигать хороших результатов при лечении вертикальных дефектов альвеолярного отростка, поскольку одним из основных недостатков коллагеновой мембраны является неспособность достичь вертикальной высоты кости.
Для решения этой проблемы была использована упомянутая комбинация. Мембраны в этих случаях нуждаются в дополнительной стабилизации с помощью мини-винтов.
Влияние толщины мембраны на регенерацию кости
До сих пор не было опубликовано достаточно исследований о влиянии толщины резорбируемой мембраны на регенерацию кости.
Попытка применения более толстой мембраны была впервые опубликована в 2005 году Busenlechner и соавт. Цель их исследования состояла в том, чтобы поставить под сомнение возможности медленно рассасывающегося прототипа трехслойной мембраны при регенерации костной ткани.
В качестве модели использовалась процедура увеличения альвеолярного отростка после экстракции первого и второго коренных зубов в нижней челюсти обезьяны. Экспериментальных животных умерщвляли через 9 месяцев.
Результаты исследования поддерживают использование медленно рассасывающейся трехслойной мембраны, потому что наилучшая достигнутая регенерация кости была достигнута с помощью этой мембраны и костного трансплантата.
Мембрана была изготовлена путем добавления полилактидного слоя между слоями коллагена, чтобы увеличить время биодеградации, а также барьерную функцию.
Фрагменты полилактидов были обнаружены при гистологических исследованиях даже через 9 месяцев после выполнения хирургического вмешательства.
Усовершенствование конструкции трехслойной мембраны может быть важным шагом в улучшении стабильности мембраны с определенной скоростью воздействия.
Тот же прототип трехслойной мембраны был изучен von Arx и соавт. В ходе их исследования рассматривался прототип трехслойной мембраны в сочетании с различными материалами.
Отличия анализировали гистопатологически и гистоморфометрически через четыре с половиной месяца. Прототип трехслойной мембраны в сочетании с аутотрансплантатом продемонстрировал лучшую регенерацию кости.
В 2009 году Козловский и соавт. провели гистологическое сравнение биодеградации мембраны Bio-Gide® (несшитой коллагеновой мембраны), которую использовали в один либо в два слоя с механическими дефектами, созданными на челюстях крысы.
Нанесение второго слоя мембраны Bio-Gide® (двухслойная техника) привело к значительному увеличению остаточного количества коллагена.
Также в ткани осталось больше барьерного материала, что указывает на более длительную барьерную функцию мембран, а также на то, что однослойная мембрана не может достичь аналогичной барьерной функции в течение длительного периода времени.
Таким образом, двухслойная мембрана для стоматологии существенно улучшает регенерацию костной ткани и не влияет на оссификацию. Следует отметить, что второй слой способствует уменьшению микроперемещений и увеличивает стабильность материала.
Трансмембранная васкуляризация проявлялась гистологически уже через 4 недели после имплантации и становилась четко выраженной через все слои мембраны спустя 9 недель после имплантации.
Несмотря на разницу в толщине двухмембранных препаратов, одинаковая степень деградации 80% для обеих мембран была достигнута уже через 9 недель.
Поскольку трансмембранное образование кровеносных сосудов необходимо для резорбции коллагена, представляется, что васкуляризация двухслойной мембраны не была нарушена из-за ее увеличенной толщины.
Утверждалось, что увеличение плотности поперечных связей между молекулами коллагена отрицательно влияет на биосовместимость, интеграцию мембраны, васкуляризацию, а также ингибирует прикрепление и пролиферацию фибробластов и остеобластов.
Использование второго слоя резорбируемой сшитой мембраны позволяет избежать этих недостатков, увеличивая долговечность стоматологической мембраны.
Эффективность двухслойных мембран при применении костных трансплантатов с точки зрения резорбции кости была проанализирована в исследованиях на кроликах.
Костные блоки теменных костей были взяты с одной стороны и помещены на другую, где покрыты мембранами. Гистологический и гистоморфометрический анализ проводили через 2, 4 и 6 месяцев после хирургического вмешательства.
Результаты исследования показывают, что применение двойных мембран значительно снижает резорбцию костной ткани трансплантата по сравнению с однослойным.
Другое исследование, проведенное сотрудниками ВМА Белграда, рассматривало воздействие коллагеновых мембран различной толщины. Результаты показали, что наилучшие результаты достигаются при использовании более толстых стоматологических мембран.
Результаты серии исследований, касающихся толщины мембран, показывают, что мембраны большей толщины, расположены ли они в несколько слоев или один — проявляют большую барьерную функцию и дольше остаются в ткани, потому что медленно разлагаются и способствуют лучшей оссификации костного дефекта.
Хотя объяснить это открытие до сих пор не удалось, предполагается, что значительное увеличение толщины мембраны и долговечности приводит к увеличению ангиогенеза и клеточной популяции коллагенового матрикса, обуславливая пролиферацию, дифференцировку клеток и активную оссификацию.
Коллагеновые мембраны человеческого происхождения
Особое внимание следует уделить рассасывающейся коллагеновой мембране для стоматологии человеческого происхождения.
Роль рассасывающейся деминерализованной мембраны человека при направленной регенерации кости и направленной тканевой регенерации изучена недостаточно.
Ряд европейских исследований, посвященных изучению влияния толщины и происхождения резорбируемых мембран на регенерацию кости, дал противоречивые результаты.
Резорбируемая деминерализованная мембрана человека (RHDM) была получена из кости черепа трупа комбинацией физических и химических методов, а именно деминерализации кортикальной кости с последовательным удалением липопротеинов.
Эксперименты показали, что RHDM обеспечивает более высокую степень регенерации костной ткани по сравнению с другими мембранами, особенно при использовании более толстых мембран.
Комбинирование ростовых факторов
и мембран для стоматологии
В последнее время включение факторов роста и дифференциации в мембрану вызывают пристальный интерес исследователей.
Существует достаточно доказательств того, что определенные факторы роста и аналогичные медиаторы могут влиять на регенерацию многих тканей, в том числе на регенерацию костей.
Примером является разработка комбинированных мембран, которые могут контролировать высвобождение трансформирующего фактора роста (TGF-β).
Местная доставка широкого спектра факторов роста, таких как тромбоцитарные факторы роста (PDGF) и костные морфогенетические белки, которые являются остеоиндуктивными факторами роста, уже с успехом использовалась в стоматологии.
Эти вещества обладают способностью дополнительно стимулировать миграцию, пролиферацию и дифференцировку клеток. Многочисленные исследования in vitro, на животных и людях продемонстрировали преимущества перечисленных факторов в комбинации с коллагеновыми мембранами.
Такие инновации могут привести к серьезным изменениям в результатах направленной регенерации костной ткани без существенных дополнительных затрат.
Заключение
В этой статье рассматриваются основные принципы использования стоматологических мембран в направленной регенерации кости.
Значительный прогресс был достигнут с тех пор, как была использована оригинальная нерезорбируемая мембрана из политетрафторэтилена (e-PTFE).
Синтетические и природные биоматериалы применяют в стоматологической практике с большим клиническим успехом уже более 20 лет; их механические свойства и скорость биодеградации постоянно совершенствуются.
Ожидается, что следующее поколение мембран будет содержать новые функциональные молекулы, улучшающие результаты направленной регенерации кости.
Можно ли обойтись без барьерной мембраны?
Так как фиксация барьерной мембраны — недешевое удовольствие, то многих пациентов интересует вопрос об альтернативах данной конструкции. В целом, стоимость различных видов и марок такого материала для стоматологических манипуляций значительно варьируется. Но если хирургическое вмешательство требует применения серьезной и надежной конструкции, то не рекомендуется приобретать дешевый аналог, ведь ожидаемого результата он все равно не принесет.
Выполнение костной пластики с фиксацией барьерных мембран доступно не всем стоматологическим клиникам. Отказ от применения таких конструкций повысит вероятность каких-нибудь осложнений, но в целом не повлияет на течение операции и восстановительный этап. Но если есть возможность применения барьерной мембраны для костной пластики при имплантации, то лучше согласиться на ее установку.