Есть два вида регенерации – физиологическая и репаративная. Под физиологической регенерацией понимают восстановление тканевых структур здорового организма по мере их старения и отмирания. Наглядным примером этого является кожа — постоянное отслоение и отшелушивание эпидермиса. Физиологическая регенерация — это постоянный и очень медленный процесс, который не вызывает стрессовой ситуации в организме.
- Регенерация костей: основные сведения
- Источники регенерации
- Стадии репаративного остеогенеза
- Средства стимуляции остеорепарации
Регенерация костей: основные сведения
Репаративная регенерация — это восстановление поврежденной или потерянной ткани. Степень и качество регенеративного процесса в различных тканей различна. Чем выше дифференцировки ткани (нервная, мышечная), тем меньше у нее способность к восстановлению своей структуры. Поэтому анатомическое восстановление поврежденного участка происходит за счет замещения дефекта соединительной тканью — рубцом. Поврежденая костная ткань способна пройти ряд стадий репаративного процесса и восстановить свою анатомическую форму, гистологическую структуру и функциональную пригодность.
Перелом кости сопровождается повреждением прилежащих мягких тканей и вызывает стрессовую ситуацию, которая сопровождается местной и общей реакциями организма. В процессе восстановления костной ткани происходят сложные общие и местные биологические и биохимические изменения, которые зависят от кровоснабжения кости, возраста больного, общего состояния организма, а также качества лечения.
The effect of low frequency electrical stimulation on bone tissue regeneration
1.Clinic premorbid and emergency conditions FKU «MONKS» them. P. V. Mandryka MO, 121002 Moscow, Silver lane,4. 2.FSBI research Institute of General pathology and pathophysiology, 125315 Moscow, the Baltic St.8. 3.FSBI Institute of biology of development. N. K. Koltsov Academy of Sciences, 119334, Moscow, Vavilov St,26. 4.LLC «Medical center HuanDi»
The study was performed on 30 male rats of Wistar line (weight 330 — 360 g, age 3.5 months). In an experimental model of damage to the femur bone in the hip joint studied the effect of low frequency electrical stimulation of the damaged area on the rate of regeneration of bone. The animals were divided into two groups. Control (15 rats) and experienced (15 rats). In the experimental animals underwent stimulation of the injury site for 5 min daily for 7 days, 14 days and 21 days. Stimulation was carried out using a device «Osteon-1» generating a mixed signal of two voltage pulse of varying duty cycle, one of which is modulated to a higher frequency. Signals were not synchronized with respect to each other, unipolar with varying frequencies and amplitudes. The obtained results show the effectiveness of the electrical stimulation currents of low frequency in the restoration of bone tissue after damage. Morphological studies showed that electrical stimulation to accelerate the regeneration of damaged bone at all stages of the study (7,14,21 day), causes a more pronounced integration of newly formed bone with the old intact bone and promote the formation of more powerful periosteal calluses in comparison with the control.
В большинстве стран мира отмечается значительное снижение смертности, вследствие этого увеличение продолжительности жизни и, соответственно, старение населения [1]. Однако улучшение деятельности здравоохранения еще не означает улучшение качества жизни, как отдельного индивидуума, так и всего общества в целом. [2]. К сожалению, прогресс, достигнутый в увеличении продолжительности жизни, не сопровождается прогрессом в уменьшении инвалидизации пожилых людей.
Следует подчеркнуть, что количество пожилых людей во всем мире стремительно увеличивается. В частности, в Российской Федерации в настоящее время доля пенсионеров по старости составляет 20,6% [3].
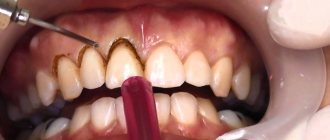
Остеопороз входит в число наиболее актуальных проблем современного здравоохранения. В России остеопорозом страдают 14 млн человек старше 50 лет. Еще у 20 млн обнаруживается остеопения [4,5]. Остеопороз занимает четвертое место по частоте инвалидизации после болезней сердечно-сосудистой системы, сахарного диабета и онкологических заболеваний.
Согласно данным ВОЗ, этим заболеванием страдают около 75 млн граждан Европы, США и Японии. В связи с постарением населения Европы к 2050 г. ожидается рост количества остеопоротических переломов шейки бедренной кости с 500 тыс. до 1 млн случаев ежегодно [6. Особенно часто остеопороз встречается у пожилых женщин вследствие снижения уровня половых гормонов. Помимо переломов отмечается также устойчивый рост дегенеративно-дистрофических заболеваний суставов (остеоартроз, остеопороз, асептический некроз). Заболевания суставов сопровождаются хронической болью. Исследования, проведенные в США показали, что у женщин, испытывающих боль, падения случаются в 1,66 раз чаще [7], а это при остеопорозе в большинстве случаев неизбежно приводит к перелому костей.
Общим патогенетическим механизмом этой группы заболеваний является – нарушение структуры костной ткани, сопровождающееся сложным локальным или системным нарушением процессов костного ремоделирования.
Все вышесказанное свидетельствует о том, что проблема лечения нарушений костного ремоделирования является актуальной и в связи с нарастающим старением населения все больше актуализируется.
Накопленный опыт медикаментозного лечения дегенеративно-дистрофических заболеваний показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество костной ткани [8]. Кроме того, следует учитывать и тот факт, что у пожилых и старых людей, как правило, имеется целый ряд коморбидных состояний и, соответственно, отмечается вынужденная полипрагмазия. Поэтому в последние десятилетия проводится интенсивный поиск возможностей применения для стимуляции остеогенеза не фармакологических, а физических методов: переменного электромагнитного поля высокой и низкой частоты, постоянного электрического тока, ультразвука, имеющих ряд преимуществ при их практическом применении [9-11]. Преимуществами этих методов воздействия являются: безопасность, возможность длительного многофакторного воздействия, отсутствие привыкания.
Опыт лечения некроза головки бедренной кости показал, что внешние электрические сигналы могут вызывать клеточную реакцию, приводящую к реконструкции поврежденной кости [12-15].
Учитывая результаты многочисленых экспериментальных и клинических исследований свидетельствующих об эффективном действии электростимуляции на различные системы организма и, в частности, на снижение тугоподвижности суставов, спастичности мышц и подавлении болевого синдрома после переломов, ускорение регенерации кости [9, 16-18] был разработан аппарат «Остеон-1» для эффективного восстановления структуры костной ткани [13].
Цель настоящей работы — гистологическое исследование эффективности восстановления костной ткани при стимуляции поврежденной кости животных с помощью прибора «Остеон-1».
Источники регенерации
Восстановление целостности кости происходит путем пролиферации клеток остеогенного слоя надкостницы, эндоста, недостаточно дифференцированных плюрипотентных клеток костного мозга, а также вследствие метаплазии гиараосальних тканей.
Современные представления о процессах регенерации костной ткани сочетают концепции неопластической и метапластическая теорий. Преостеогенными клетками считают остеобласты, фибробласты, остеоциты, перициты, гистиоциты, лимфоидные, жировые и эндотелиальные клетки, клетки миелоидного и эритроцитного рядов.
При сращения сломанных костей установлена стадийность репаративного остеогенеза, которая имеет условный характер. Деление на стадии не имеет принципиального значения, поскольку они в динамике перекрываются.
Даже при идеальной репозиции и фиксации отломков дифференцировки различных клеток происходит одновременно, и поэтому стадийность репаративного процесса трудно разграничить. Но для выбора оптимальной тактики лечения больных нужно иметь представление о закономерностях репаративного остеогенеза.
Методика
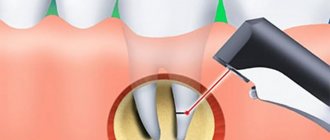
Работа выполнена на 30 крысах-самцах линии Wistar (вес 330 — 360 г, возраст 3,5 мес). Крыс содержали в стандартных условиях по 5 особей в клетке с контролируемыми режимами температуры (24 oC) и освещения (в течение 12 ч) и со свободным доступом к воде и пище. Операцию по моделированию травмы проводили под общим наркозом. Сначала животных анестезировали легким эфирным наркозом. Для более глубокого наркоза, использовали хлоралгидрат, внутрибрюшино, в дозе 300 мг/кг. Затем животное фиксировали на операционном столике, состригали шерсть в области левого бедра и скальпелем разрезали кожу и мышечную ткань. Бедренную кость в области тазобедренного сустава обнажали, просверливали бедренную кость до костномозгового канала на 8-10 мм дистальнее сутава с помощью миниатюрной стоматологической бормашины (диаметр бора 0,8 мм). После повреждения кости производили послойное ушивание мягких тканей. Животных разделяли на две группы. Контрольную (15крыс) и опытную (15 крыс). У подопытных животных с помощью прибора «Остеон-1» проводили стимуляцию области травмы по 5 мин ежедневно в течение 7 сут. (оп7), 14 сут. (оп14) и 21 дня (оп21). Для этого животных фиксировали на операционных столиках и через введенные под кожу хирургические иглы подавали смешанный сигнал из двух импульсных напряжений разной скважности, один из которых модулирован более высокой частотой. Сигналы были не синхронизированными относительно друг друга, однополярными с изменяющимися частотами и амплитудами. Катод располагался в области травмы, анод помещался на ту же лапу дистальнее. Электростимуляцию осуществляли под общим наркозом (хлоралгидрат в дозе 190-200 мг/кг, внутрибрюшинно).
Три группы животных с нанесенной травмой служили контролем (к7, к14, к21), они также располагались на препаровальных столиках, им вводились хирургические иглы, но стимуляция не осуществлялась. В каждом варианте опыта использовали по 5 животных. На следующий день по окончании исследований животные выводились из эксперимента путем цервикальной дислокации. Затем извлекали бедренные кости всех 6-ти групп, которые использовали для гистологического анализа и оценки выраженности патологического процесса и процесса остеогенеза.
Кости животных фиксировали 24 часа при комнатной температуре в 10% формалине, приготовленном на фосфатно-солевом буфере (ФСБ, 0,02М, рН7.6). Декальцинировали в 5% трихлоруксусной кислоте 48 часов, затем промывали в ФСБ и замораживали в изопентане при -400С. Далее приготавливали срезы толщиной 5 мкм. Срезы высушивали при комнатной температуре в течение 1 часа и окрашивали гематоксилин-эозином. Для гистологического анализа от каждого животного было изготовлено от 100 до 200 серийных срезов бедренной кости, сделанных в поперечном и продольном направлениях. С помощью микроскопа Олимпус (ок. 10х, об. 4х). делали микрофотографии срезов костной ткани. Морфометрический анализ костной ткани внутри раневого канала (интермедиарная костная мозоль) осуществляли с помощью программы ImageJ [19]. Площадь костной ткани, измеренной на 3-5 срезах от каждого животного, выражали в % от площади канала. Для определения достоверности различий между опытом и контролем использовали непараметрический двусторонний критерий Манна-Уитни (U-тест).
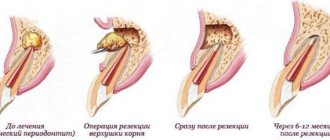
Стадии репаративного остеогенеза
Стадия катаболизма тканевых структур и клеточной инфильтрации. По сравнению с воспалением это стадия альтерации (разрушение). После травмы возникают омертвения поврежденных тканей и распад клеточных элементов гематомы.
Организм человека немедленно реагирует на травму местной фагоцитарной реакцией. Наряду с этим продукты распада, которые являются генетическими индукторами, вместе с гормонами обусловливают репродукцию и пролиферацию различных специализированных клеток (остеоциты, гистиоциты, фиброциты, лимфоидные, жировые и эндотелиальные клетки), то есть мелкоклеточная инфильтрацию, которая длится 6—10 дней.
Стадия дифференцировки клеток длится 10—15 дней. В основном ДНК и РНК, а также анаболические гормоны направляют дифференцировку клеток прогрессирующего мелкоклеточного инфильтрата. Одновременно происходит три типа дифференцировки клеток: фибробластические, хондроидные и остеогенные. Это зависит от условий, при которых происходит репаративный процесс.
При идеальных репозиции и фиксации отломков и достаточном кровоснабжении (применение аппаратного остеосинтеза т.д.) сращение происходит по типу первичного остеогенеза. Дифференцировка большинства клеток сразу направлена на образование остеоидной ткани. Когда фиксация ненадежна или недостаточное кровоснабжение отломков вследствие тяжелых повреждений, дифференцировки клеток происходит путем фиброгенеза с последующей метаплией в хрящевую и костную ткани.
Стадия формирования первичного остеона — образование ангиогенной костной структуры — происходит в течение 16—21 дней. Характеризуется она тем, что возникает полная реваскуляризадия первичной мозоли. Регенерат прорастает капиллярами и начинается минерализация его белковой основы. Появляется мелкопетличная, хаотично ориентирована сетка костных трабекул, которые постепенно сливаются с образованием первичного остеона и гаверсовых канальцев.
Стадия перестройки первичного регенерата или спонгиозации мозоли, — это та стадия, на которой формируется пластинчатая костная ткань. Во время перестройки первичного регенерата костный пластинчатый остеон набирает ориентации над силовыми линиями нагрузки, появляется корковое вещество кости, надкостницы и восстанавливается костно-мозговая полость. Части регенерата, которые за нагрузкой, рассасываются. Все это приводит к полному восстановлению структуры и функции переломанной кости. В зависимости от локализации перелома процесс перестройки и восстановления может длиться от нескольких месяцев до 2—3 лет.
Итак, из закономерностей репаративной регенерации костной ткани вытекают следующие практические выводы:
1) идеальной репозиции и фиксации костных отломков следует добиваться быстрее, к тому же не позднее, чем начнется стадия дифференцировки клеток;
2) поздняя репозиция, любое вмешательство с целью коррекции отломков ведут к повторному разрушению капилляров регенерата и нарушению репаративного остеогенеза;
3) стимулятором образования пластинчатой кости в процессе перестройки первичного регенерата является функциональная нагрузкп, о которой следует помнить при лечении больных.
Теоретически различают три вида репаративной регенерации костной ткани — первичная, первично-замедленная и вторичное сращение. Первичное сращение костей происходит в течение короткого времени первичным остеогенезом за счет образования интермедиарной мозоли. Но для этого следует создать все условия. Прежде всего это наблюдается при забойных и компрессионных переломах костей, часто после идеальной репозиции (диастаз между отломками 50—100 мкм) и надежной фиксации отломков.
Первично-замедленное сращение бывает тогда, когда между неподвижными отломками нет щелей, сращения проходит только по сосудистым каналам (интраканаликулярный остеогенез), т.е. возникает частичное сращение, а полному межкостному сращиванию предшествует резорбция концов отломков. Но с практической точки зрения этот вид репарации следует расценивать как положительный, и поэтому клиницисты придерживаются разделения на два вида восстановления кости — первичное и вторичное.
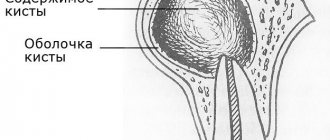
Вторичное сращение переломанных костей происходит за счет образования менее полноценных видов мозоли — периостальной, эндостальной и параосальной (гематома, мягкие ткани).
Образованием избыточной периостальной и параосальной мозоли организм пытается компенсировать фиксацию отломков, которой не сделал врач. Это природный саногенез организма. В этом случае срок сращения кости значительно увеличивается. По характеру мозоли на рентгенограмме можно сразу оценить качество лечения больного. Чем больше мозоль, тем хуже была фиксация отломков.
Вторичное сращение кости сравнивают с заживлением ран мягких тканей. Но в заживлении поражения двух тканей принципиальная разница. Заживление раны мягких тканей, происходит вторичным натяжением, заканчивается образованием рубца, в то время как при переломе кости в процессе репарации все костные клетки проходят стадию метаплазии, что заканчивается образованием полноценной кости. Однако для того чтобы кость срослась вторично, необходима также надежная фиксация отломков. Если ее не будет, то клетки пройдут стадии фибро- и хондрогенеза, перелом заживет, но кость не срастется.
Вопрос о стимуляции репаративного остеогенеза в теоретическом плане остается нерешенным. Попытки ускорить регенерацию костной ткани уже были давно, и сейчас не уменьшается количество поисков.
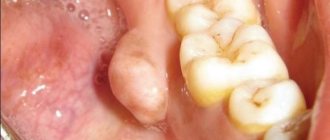
Особенности направления костной регенерации (НКР)
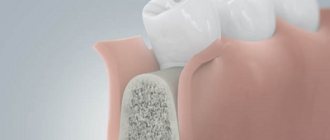
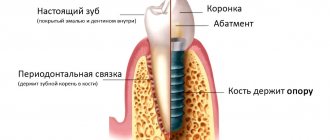
Направленная костная регенерация представляет собой хирургическую процедуру, которая позволяет увеличить объем костной ткани. Во время операции происходит наращивание твердой части челюсти. В результате этого увеличивается ее высота и ширина.
Все хирургические методики востребованы в протезировании. Благодаря наращиванию твердой части челюсти врач сможет качественно и надежно установить зубной имплантат. Для выполнения процедуры используют костный заменитель. С его помощью врач сможет придать кости нужную форму. Материал надежно крепят к остаткам родной костной ткани барьерной мембраной.
После этого происходит процесс обрастания кровеносными сосудами и клетками, которые отвечают за активный рост кости. Когда процесс будет завершен, врач сможет полноценно установить имплантаты, зубные протезы.
Примеры работ «До» и «После»
Восстановление всех зубов на верхней и нижней челюсти — базальная имплантация
Случай: частичное отсутствие зубов на верхней и нижней челюсти, осложненное тяжелой формой пародонтита (подвижность зубов).
Комплексная одномоментная имплантация нижней челюсти
Случай: на нижней челюсти имелся расшатавшийся мост из 4 передних зубов, после диагностики было назначено удаление оставшихся зубов и косплексная базальная имплантация.
Восстановление всех зубов методом базальной имплантации (март 2012)
Случай: частичная адентия, оголенные корни собственных зубов, пародонтит, повышенная подвижность зубов, сильная атрофия костной ткани в некоторых местах свыше возможных норм для классической имплантации зубов.
Восстановление передних зубов методом базальной имплантации (апрель 2012)
Случай: частичное отсутствие передних зубов и разрушение опорных зубов под протезом, нарушен рельеф десны и межзубных сосочков.